日本のドラッグ・ラグ問題~なぜ新薬の承認がこんなに遅い?

「日本は新薬の発売が、海外よりも遅い」という話を聞いたことがあると思います。これは「ドラッグ・ラグ」と呼ばれ、特に難病の治療を受けている患者さんにとっては歯がゆい問題です。
「治験に時間がかかりすぎる」ことが主な原因ですが、一方で承認が早すぎるのも薬害事件を生み出しかねないため、非常に難しい問題となっています。
高額な薬を個人輸入するしかない患者さんも

ドラッグ・ラグとは主に、新薬の開発から発売までにかかる時間の長さ、もしくは海外の薬が国内で承認されるまでの時間差のことを指します。
スポンサーリンク
特に海外でとっくに使われている薬が、日本では未承認の時によく使われる言葉です。
まだ特効薬のないような難病の場合、少しでも効果的な薬を早く患者さんの手元に届けることは非常に重要になります。しかし海外で新薬が開発されても、実際に日本の患者さんが保険で使えるようになるまでには数年かかることが一般的です。
そのため、承認されるまでは全額自己負担で患者さんが個人的に輸入するしかない現状となっています。
特に抗がん剤などは高額なため、未承認のものを使うとなると月に数十万~100万かかることも珍しくありません。
日本のドラッグ・ラグの原因は複数ある!

なぜ日本では海外より新薬の認可が遅いのかというと、1つは「治験にかかる時間が長いから」です。薬の効果や安全性を確認するために治験がおこなわれることは当然なのですが、日本ではとにかく年数がかかることが問題視されています。
日本で薬の承認をおこなうのは、「医薬品医療機器総合機構」という独立行政法人ですが、まず審査担当者が少ないという問題があります。さらに治験をおこなうためには患者さんが必要なため、医師の協力が必須ですが、日本ではこれに積極的に参加する医師が少ないことも問題となっています。
たとえば海外では治験を担当する医師と製薬会社が直接契約を結び、報酬も製薬会社から入る仕組みになっているのですが、日本ではこのシステムが確立されていません。
逆にいえば、医師と製薬会社との癒着を防ぐ目的もあるのですが、結果的に多忙の合間を縫ってまで治験に協力しようとする医師が少ないという弊害につながっています。
さらに、治験に協力する患者の少なさも問題です。たとえばアメリカでは国民皆保険制度がないだけに、高度な医療を受けようと思うと多額の費用がかかってしまいます。
ところが治験に参加すれば、最新の薬を無料で使うことができますので、患者さんにとっては大きなメリットとなります。
しかし日本では保険制度が充実しているために、金銭面でのインセンティブはなかなか働きにくいのが現状です。そのため海外よりも患者さんを集めるのに時間がかかってしまいます。
また海外の製薬会社にとっても、治験に長い時間がかかる上、安全性や有効性に慎重な姿勢を見せる日本は「魅力的な市場」とはいえません。ですからまずは欧米で一定の効果をあげてから、そのデータをもとに日本に売り込もうと考えます。
このような結果、日本と欧米の間には、平均4年のドラッグ・ラグがあるいわれるほどです。
スポンサーリンク
型遅れの医療機器が使われ続ける「デバイス・ラグ」も
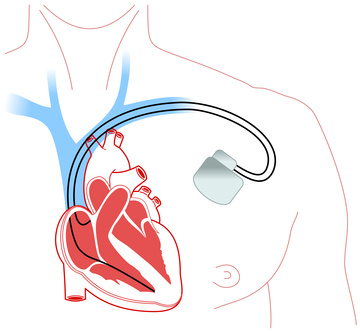
さらに日本では薬のみならず、最新の医療機器の導入も遅れがちです。これを「デバイス・ラグ」といいます。
1つは欧米人と日本人の体格の違いが原因です。両者では臓器や血管の大きさに差があることから、海外で開発された医療機器をそのまま日本人に使えるとは限りません。
そこで日本人に使えるよう改良を加えた上で審査を受ける必要があります。
特に患者数の少ない難病の医療機器は、承認されるまでに長い時間がかかるとして問題視されています。実際よく使われるCTやMRIなどの検査機器は比較的早く最新のものが導入される一方、使用する人の多くない心臓のペースメーカーなどは、日本ではかなり型遅れのものが使われているのです。
その結果メーカー側も日本のために古い部品を供給し続けなければいけなくなっています。
スピーディすぎる承認には、副作用被害の問題も…
もっとも、最近では治験の期間を短縮しようとする動きが活発化し、以前よりはだいぶ改善されているといわれます。治験に対する医師の理解も高まりつつありますし、さまざまな規制をゆるめるなどして、治験の迅速化が進められています。
一方、アメリカでは日本とは逆に、薬や医療機器が十分な治験を経ないままスピーディに広まりすぎるという別の問題が起こっています。とにかく必要とする患者さんの元へいち早く最新の薬を届けるべきだとする考えが根づいているため、確かに承認・販売は早いのですが、そのぶん重大な副作用などの「薬害問題」もいくつか起きています。
この問題が日本で浮き彫りとなったのが、「イレッサ訴訟」です。「夢の抗がん剤」として日本が珍しく世界に先駆けて承認した「ゲフィチニブ(商品名:イレッサ)」では、間質性肺炎による死亡事故が多数起こり、訴訟問題になりました。
結果的には「国や製薬会社の過失とは認められない」として遺族側が敗訴するという形になりましたが、薬の承認と安全性に関して大きな課題を提示した裁判でした。
つまり逆に考えるなら、ドラッグ・ラグがあるということは「既に海外である程度の副作用が明らかになってから導入できるため、結果的に安全な使用ができる」というメリットもあるのです。
とはいえ1日も早い治癒を望む難病の患者さんを思うと、そう長く様子見してもいられません。
もちろん理想的なのは「スピーディに薬の安全性が確認されること」です。人員不足などの、安全性とは関係のない組織の弊害を排除した上で、治験は十二分におこなわれる必要があります。
遅すぎるドラッグ・ラグも早すぎるドラッグ・ラグも、どちらも問題だということです。
By 叶恵美
スポンサーリンク









